Super-PAGETM免染预制胶(Bis-Tris)是一款安全、快捷、高性能的预制聚丙烯酰胺凝胶,可用于蛋白分离。其蛋白条带紫外曝光即可成像,无需染胶。
本预制胶加样孔数分为12孔/15孔,推荐最大上样量为35μL/25μL,详细尺寸如下:
胶板:长×宽×高为100×85×4.7mm;
凝胶:长×宽×高为85×70×1mm。
此外,随胶配套的Tris/MOPS/SDS电泳缓冲液为中性,可大幅提高凝胶的稳定性,并可有效避免蛋白在电泳过程中发生再修饰。
紫外成像
无需染胶,蛋白条带可直接紫外曝光成像分辨率高
全新凝胶缓冲体系配方使蛋白电泳条带更清晰锐利,分辨率更高性能优越
针对性的设计有效降低边缘效应,轻松获得理想的电泳结果稳定性高
采用自动化灌胶生产技术,确保了产品质量的高稳定性和重复性操作简便
即开即用,无需额外配制各种缓冲液和灌胶操作,并配有Tris/MOPS/SDS电泳缓冲液兼容性强
兼容市场上主流的mini电泳槽,包括:雅酶、Bio-Rad Mini-PROTEAN(II/3/Tetra System),Hoefer Mighty Small(SE250/SE260/SE280),北京六一DYCZ-25E、DYCZ-24DN、DYCZ-24K、DYCZ-24KS、DYCZ-24KF,君意东方JY-SCZ2+,天能VE180,以及其它能容纳胶板宽度为10cm的电泳槽安全性高
无需接触有毒试剂
从包装袋中取出预制胶,如下图所示,将胶板底部的粉色胶带撕去;

将梳子按箭头方向从胶板中平稳地平行推出;
装胶前准备工作,以Bio-Rad或雅酶等品牌电泳设备为例,请按如下步骤操作:
这类电泳槽的U型密封条顶部有突起结构,而雅酶Super-PAGETM系列预制胶该部位是平的,因此电泳前需将具有突起结构的密封条取出后反向安装,使平滑面朝外,从而防止漏液(如下图所示)。具体操作如下:
a.将电泳槽中的U型密封条(如图红色部分)拉出,注意这时的密封条两端是有突起的,突起的一面为正面,无突起的为反面;


b.将密封条旋转180°(正面朝里,反面朝外),重新装回电泳装置中,注意把密封条周边压实,防止发生漏液;


按下图所示方法将预制胶安装到电泳装置中;


向电泳槽的内槽中加入足量的1×Tris/MOPS/SDS电泳缓冲液,浸没点样孔并使液面停留在其上方5mm处,接着在外槽中也加入足量的1×Tris/MOPS/SDS电泳缓冲液,以确保电泳过程中适当的冷却效果;
注意:
①确保外槽电泳缓冲液面低于内槽液面,不可漫过胶板;
②Tris-Glycine电泳缓冲液与本产品的Bis-Tris缓冲体系不兼容,请勿使用。
使用注射器或其它工具吸取适量1×Tris/MOPS/SDS电泳缓冲液 ,将点样孔轻轻冲洗干净,去除气泡和残留的储存缓冲液。将上样缓冲液处理后的蛋白样品加入点样孔,启动电泳,推荐电压为140~150V,最高不超过180V;
电泳结束后,从胶板中取出凝胶,即可放入成像仪紫外曝光成像,或在紫外切胶台上直接观察。取胶具体操作步骤如下:
⑴待电泳结束后,将胶板从电泳槽中取出;
⑵用撬具小心插入胶板之间的空隙,按下图所示慢慢撬动胶板上、中、下三个位置,直至胶板两侧完全分开;

⑶胶板撬开之后,凝胶可能还会粘在其中一块胶板上,只需将胶板附着凝胶的一侧浸入水中,贴着水面将其倾斜轻轻提起,凝胶即可脱离,将凝胶从水中取出进行后续实验。
注意:①紫外激发荧光基团需一定时间,一般经1~5min,凝胶上即可呈现清晰的蛋白条带;
②观察Western Blot转印后膜上蛋白条带,必须在电泳后,将凝胶经紫外激发出现清晰条带后,再进行转膜操作。若直接转膜再用紫外激发,荧光信号会很弱或无信号。
分离图谱(Tris/MOPS/SDS电泳缓冲液,雅酶蛋白分子量标准WJ103,蛋白条带分子量单位:kDa)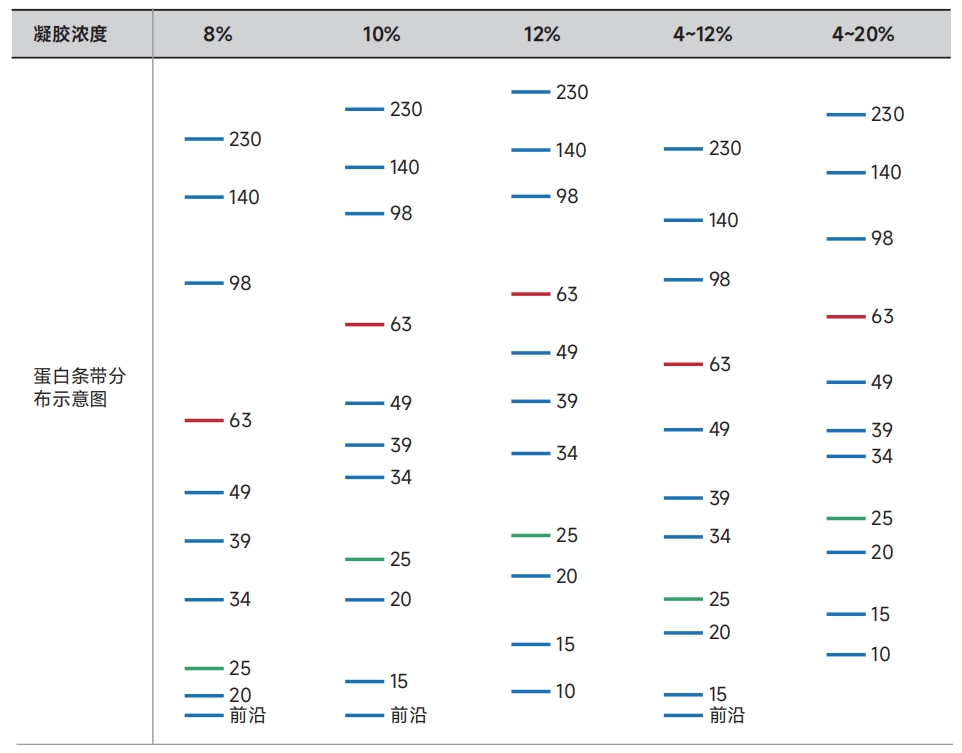
1.
蛋白电泳示踪染料溴酚蓝扭曲、电泳时间大幅度延长:
●可能是内槽电泳缓冲液泄漏导致。建议重新夹胶板,防止在电泳过程中内槽液面逐步降低;
2.
电泳时泳道拖尾严重,点样孔样品滞留明显:
●可能原因是样品处理不充分:
a.裂解处理不够充分。建议降低裂解前的样品浓度,或增加裂解液的比例,使样品充分裂解;
b.上样缓冲液处理不充分。建议对裂解后的样品进行稀释后,再进行上样缓冲液处理;
3.
蛋白条带中间凹陷,两边突起:
●可能原因是样品盐离子浓度或表面活性剂浓度过高。建议稀释样品或对样品进行透析后,再进行上样缓冲液处理和上样。
1. 电泳缓冲液不建议重复使用,因为电泳之后缓冲液的离子强度、缓冲能力都会发生变化,不能确保电泳效果;
2. 电泳结束后,可以使用Tris-Glycine转膜液进行转膜。将凝胶浸泡在转膜液中10~15min, 使其充分平衡,再进行转膜;
3. 上样时,移液器吸头切勿过度插入点样孔,以免戳破凝胶造成漏液;
4. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
5. 本产品仅限科研使用。