本产品采用TUNEL(TdT mediated dUTP Nick End Labeling)法,可高灵敏度且简单快速地检测细胞凋亡,对于细胞样本(细胞涂片、细胞爬片、悬浮细胞)或组织样本(石蜡切片、冰冻切片),只需经过一步染色反应,洗涤后便可通过荧光显微镜或流式细胞仪检测被标记上红色荧光的凋亡细胞。
细胞凋亡时,细胞内的特异性核酸内切酶会被活化,并使染色质DNA在核小体间被特异性切割,DNA降解成180~200bp或其它整数倍片段。DNA分子断裂产生的3'-OH末端可以在末端脱氧核糖核苷酸转移酶(Terminal Deoxynucleotidyl Transferase,TdT)的作用下结合Dye555-dUTP,被标记的DNA可以直接使用荧光显微镜观察或通过流式细胞仪进行定量分析,从而反映细胞凋亡的水平。
示意图如下: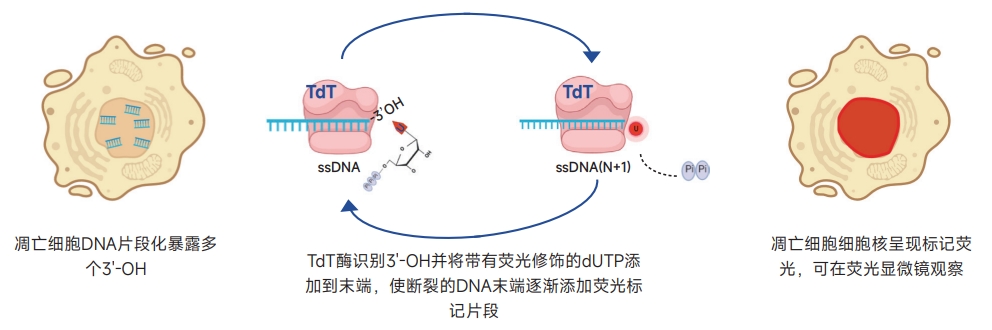
组织样本(石蜡切片、冰冻切片)及细胞样本(细胞爬片、细胞涂片、悬浮细胞)。
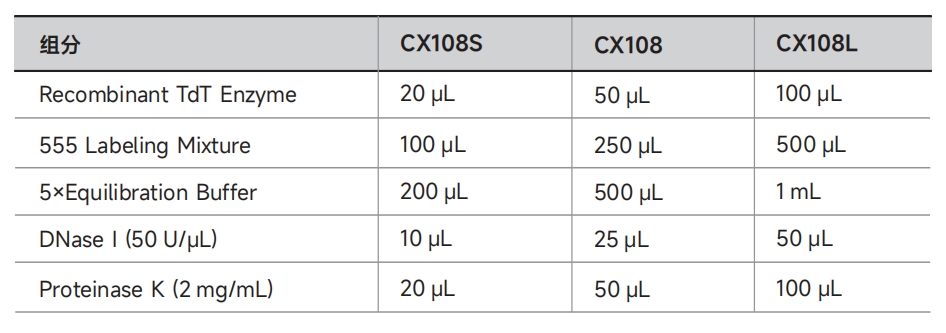
DAPI/PI、Triton X-100、1×PBS、4%多聚甲醛、无水乙醇。
配置工作液
1×Proteinase K工作液:取1μL Proteinase K(2mg/mL)加入99μL 1×PBS中,混匀。现用现配。
1×DNase I工作液:用1×PBS按1:100的比例稀释DNase I(50U/μL),使其终浓度为0.5U/μL。现用现配。
注意:DNase I会在剧烈混合下变性,建议不要涡旋DNase I溶液。
样本预处理
A. 贴壁细胞(细胞爬片/涂片)
1. 准备细胞爬片: 在TC处理的细胞爬片上培养贴壁细胞。在对细胞进行凋亡诱导处理之后,用1×PBS漂洗爬片两次,转步骤2;准备细胞涂片:以2×106cells/mL的浓度将细胞重悬于1×PBS中。吸取50~100μL细胞悬液滴于多聚赖氨酸包被的载玻片上,用一片干净的载玻片轻柔地涂开细胞悬液,转步骤2。 2. 固定:将爬片/涂片浸入1×PBS配制的4%多聚甲醛溶液,常温进行细胞固定15min; 3. 将爬片/涂片浸入1×PBS中漂洗两次,每次常温放置5min; 4. 轻柔地去掉多余液体,并用吸水纸吸干爬片/涂片上样本周围的液体; 5. 通透:将爬片/涂片浸于1×PBS配制的0.2% Triton X-100溶液中,常温孵育10min; 6. 用1×PBS润洗样本2~3次。轻柔地去掉多余的液体,并用吸水纸小心吸干载玻片上样本周围的液体。在实验过程中,切勿让样本干燥。处理好的样本需放入湿盒中保持湿润。
B.悬浮细胞
1. 取3×106~5×106个细胞,用1×PBS漂洗两次,每次离心5min(300×g,4℃),然后用0.5mL 1×PBS重悬; 2. 固定:向细胞悬液中加入5mL 1×PBS配制的1%多聚甲醛溶液,4℃进行细胞固定20min; 3. 离心5min(300×g,4℃),弃上清,用5mL 1×PBS重悬细胞; 4. 再次离心5min(300×g,4℃),弃上清,用0.5mL 1×PBS重悬细胞; 5. 通透:向细胞悬液中加入5mL 70%乙醇(冰上预冷),冰上破膜30min; 注意:①通透后的细胞折射率会下降,导致其边缘模糊不易观察,操作过程中应格外小心,避免丢失细胞; ②-20℃的条件下,细胞能在70%乙醇中保存一周。
6. 将通透后的细胞离心5min(300×g,4℃),弃上清,用5mL 1×PBS重悬细胞; 7. 再次离心5min(300×g,4℃),弃上清,用1mL 1×PBS重悬细胞; 8. 转移2×106个细胞至新的1.5mL离心管中,进行后续标记实验或阳性对照制备。
C.石蜡切片
1. 脱蜡:将石蜡切片置于二甲苯中浸泡10min;换用新鲜二甲苯再浸泡10min;更换50%的二甲苯再浸泡5min;无水乙醇中浸泡5min;更换新的无水乙醇再浸泡5min;更换95%乙醇浸泡5min;更换85%乙醇浸泡5min;更换75%乙醇浸泡5min;更换50%乙醇浸泡5min;更换30%乙醇浸泡5min;更换1×PBS浸泡5min; 2. 通透:用吸水纸吸干载玻片上切片组织周围的多余液体,每个样本上滴加100μL 1×Proteinase K工作液,使溶液覆盖全部样本区域,37℃反应10min; 注意:不同组织或物种的样本所需反应时长可能不同,Proteinase K通透时间过长会增加组织切片在后续洗涤步骤中从载玻片上脱落的风险,时间过短则可能造成通透处理不充分,影响后续标记效率。建议进行预实验,确定最佳Proteinase K孵育时长。 3. 将通透后的样本浸入1×PBS漂洗3次,每次5min。轻柔地去掉多余液体,并用吸水纸小心吸干载玻片上样本周围的液体。在实验过程中,切勿让样本干燥。处理好的样本需放入湿盒中保持湿润。
D.冰冻切片
1. 固定:将冰冻切片平衡至常温,浸入1×PBS配制的4%多聚甲醛溶液,常温固定15min; 2. 将固定后的冰冻切片浸入1×PBS漂洗两次,每次5min; 3. 通透:用吸水纸吸干载玻片上切片组织周围及背面的多余液体,每个样本上滴加100μL 1×Proteinase K工作液,使溶液覆盖全部样本区域,37℃反应10min; 注意:不同组织或物种的样本所需反应时长可能不同,Proteinase K通透时间过长会增加组织切片在后续洗涤步骤中从载玻片上脱落的风险,时间过短则可能造成通透处理不充分,影响后续标记效率。建议进行预实验,确定最佳Proteinase K孵育时长。 4. 将通透后的样本浸入1×PBS漂洗3次,每次5min。轻柔地去掉多余液体,并用吸水纸小心吸干载玻片上样本周围的液体。在实验过程中,切勿让样本干燥。处理好的样本需放入湿盒中保持湿润。
标记及检测
1. 分组设置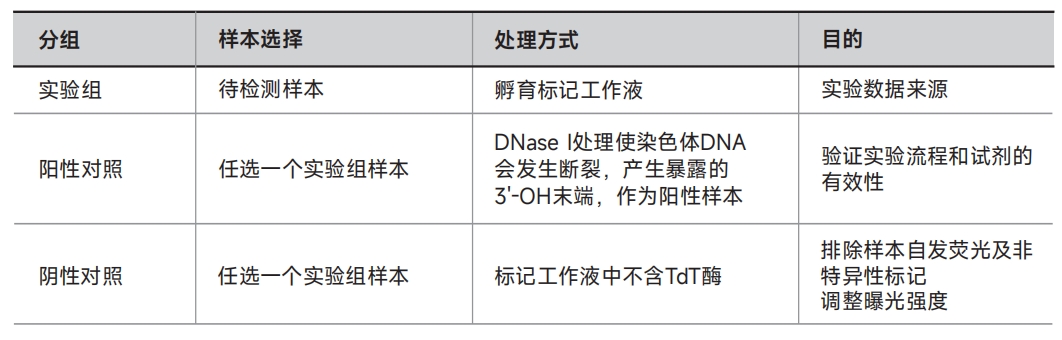
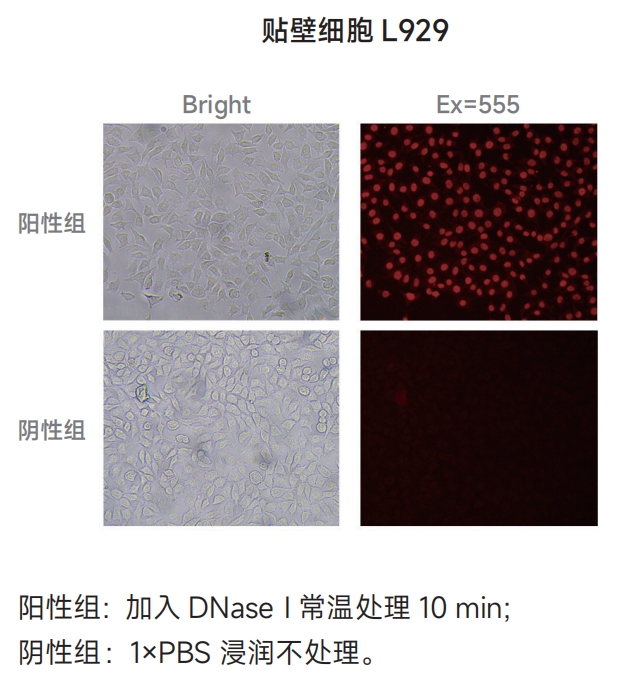
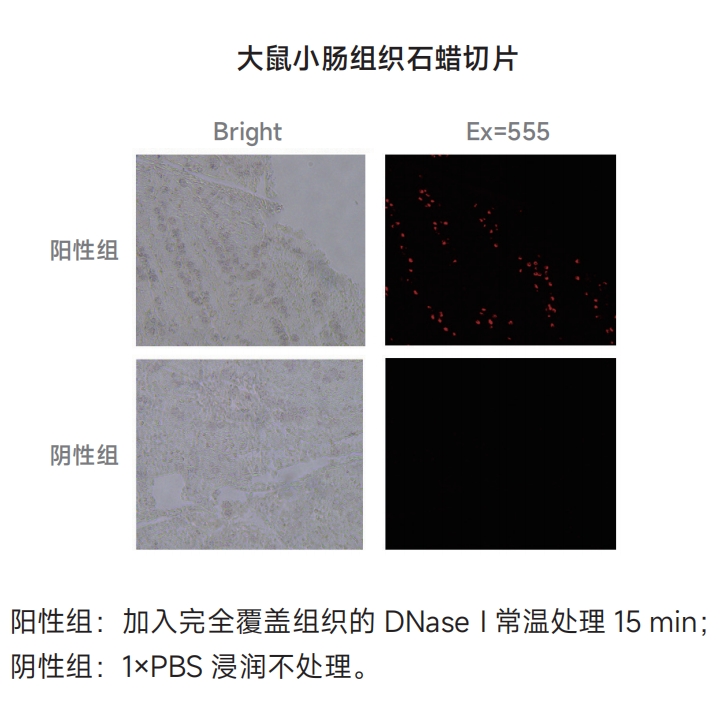
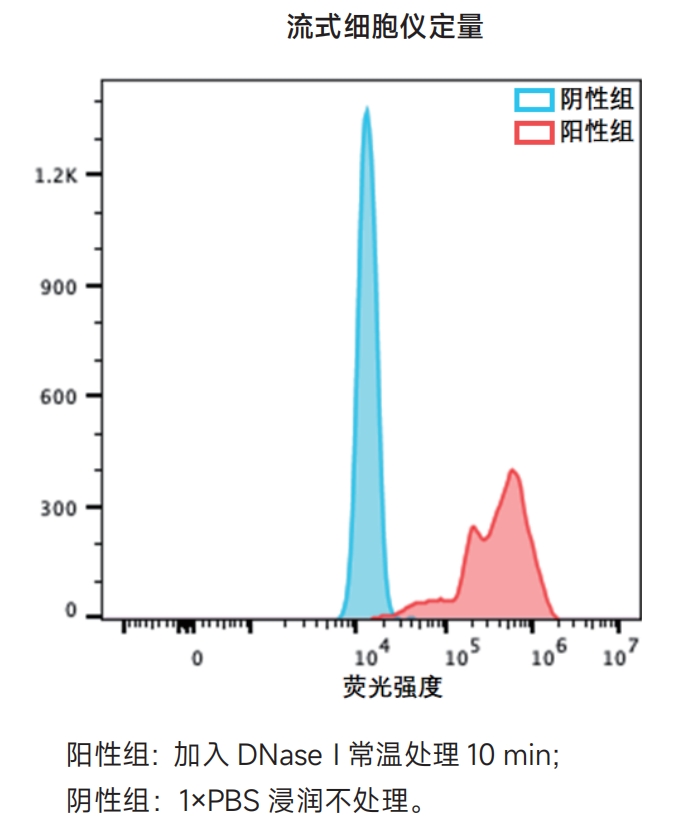
制备阳性对照 ⑴向通透后的样本(如果是悬浮细胞,需要离心去除上清)加入50μL 1×DNase I工作液(0.5U/μL),一定要覆盖住整个样本,常温孵育10min; ⑵将样本浸入1×PBS漂洗3次,每次5min。 注意:阳性对照必须使用单独的染色缸,否则其上残留的DNase I可能会使实验组出现假阳性信号。 2. 按照下表配制标记工作液;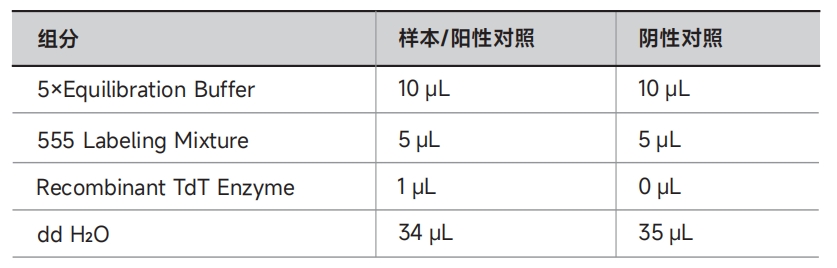
注意:以上为单个样本所需标记工作液的用量,50μL×样本/对照数量 即为所需标记工作液的总体积。 3. 标记与检测 A.对于细胞爬片/涂片、石蜡切片或冰冻切片 ⑴用吸水纸吸去预处理后的样本上多余的液体,若样本反应面积小于5cm2,在其上滴加50μL上步配制的标记工作液,若样本反应面积大于5cm2,可按比例增加标记工作液用量; 注意:①请严格避免干片; ② 请勿将吸水纸接触到细胞或者组织; ③ 滴加标记工作液后,样本需要避光处理。 ⑵将封口膜剪成与组织或爬片同等大小,轻盖在样本上以保证试剂分布均匀,将样本置于湿盒内(湿盒的底部需铺上用水浸湿的纸巾),37℃避光孵育60min; ⑶轻柔地去掉样本上多余的液体,用1×PBS漂洗3次,每次5min; 注意:为将游离的未反应标记物去除干净,样本在用1×PBS漂洗后,可用含0.1% Triton X-100和5mg/mL BSA的1×PBS再漂洗3次。 ⑷用吸水纸轻柔地吸干样本周围多余的液体,并向样本区域滴加100μL 1×PBS配制的20%甘油,以保持样本湿润,即可在荧光显微镜直接观察分析样本; 注意:如需DAPI或PI复染,可在甘油封片前加入用1×PBS配制的2μg/mL DAPI溶液或1μg/mL PI溶液,常温避光孵育5min。用1×PBS漂洗3次后再进行甘油封片。 ⑸立即在荧光显微镜下观察分析样本。 ◇555红色荧光染料的最大激发波长是554nm,最大发射波长是567nm; ◇DAPI与双链DNA结合时最大激发波长是358nm,最大发射波长是461nm; ◇PI与核酸结合时最大激发波长是535nm,最大发射波长是617nm。 B.对于悬浮细胞 ⑴对于2×106个细胞的一个标准反应,所需标记工作液的用量是50μL。将预处理步骤准备好的2×106个通透后的细胞离心5min(300×g,4℃),弃上清,加入50μL标记工作液重悬细胞,37℃避光孵育60min,每隔15min轻弹管壁或用微量移液器轻轻重悬细胞; ⑵将标记后的细胞离心5min(300×g,4℃),弃上清,用含0.1% Triton X-100和5mg/mL BSA的1×PBS重悬细胞; ⑶重复上一步骤一次; ⑷离心5min(300×g,4℃),弃上清,用0.5mL 1×PBS配制的5μg/mL PI溶液重悬细胞,其中包含250μg DNase-free的RNase A; ⑸常温避光孵育60min; ⑹用流式细胞仪检测细胞,也可在荧光显微镜下观察,参考前述激发/发射波长。
1. 本说明书中推荐的实验条件是通用的,用户可根据不同的样本类型和预实验结果,对样本处理时间、试剂浓度等条件进行优化,以确定最适实验条件;
2. 产品组分避免反复冻融;
3. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
4. 本产品仅限科研使用。