Mouse TGF-β1 ELISA Kit
| 货号 | HJ205 |
| 规格 | 96次 |
| 检测范围 | 15.62pg/mL~1,000pg/mL |
| 敏感性 | 2pg/mL |
| 特异性 | 系统和其它因子无交叉反应 |
| 样本类型 | 小鼠血清、血浆、体液、组织匀浆或细胞培养上清 |
本试剂盒采用双抗体夹心ELISA法检测样品中小鼠TGF-β1的浓度。小鼠TGF-β1捕获抗体已经预包被于酶标板上,当加入样品或标准品时,其中的小鼠TGF-β1会与捕获抗体结合,而其它游离成分则会通过洗涤被除去。接着,再加入生物素标记的小鼠TGF-β1抗体后,抗小鼠TGF-β1抗体与小鼠TGF-β1结合,形成夹心的免疫复合物,其它游离成分则通过洗涤被除去。随后加入酶复合物,生物素与酶复合物特异性结合,这样酶复合物上的HRP就与夹心的免疫复合物连接起来,而其它游离成分则通过洗涤被除去。最后加入显色剂,若样品中存在小鼠TGF-β1,则会形成免疫复合物,其上连接的HRP会催化无色的显色剂氧化生成蓝色物质,而后加入终止液,最终产物呈黄色。通过酶标仪检测,读取450nm处的OD值,小鼠TGF-β1浓度与OD450值之间呈正比,通过检测标准品绘制标准曲线,对照未知样品中OD值,即可计算出样品中小鼠TGF-β1的浓度。
| 分组 | 体积或数量 |
| 小鼠TGF-β1预包被板 | 8孔条×12个 |
| 样品稀释液 | 30mL |
| TGF-β1活化剂Ⅰ | 2mL |
| TGF-β1活化剂Ⅱ | 2mL |
| 重组小鼠TGF-β1标准品(冻干) | 2支(10ng/支) |
| 生物素标记小鼠TGF-β1抗体 | 130μL(效价1:100) |
| 抗体稀释液 | 12mL |
| 酶复合物(HRP标记的链霉亲和素) | 130μL(效价1:100) |
| 酶复合物稀释液 | 12mL |
| 浓缩洗涤液(25×) | 30mL |
| 显色剂TMB | 10mL |
| 终止液 | 10mL |
| 封板胶纸 | 4张 |
1. 根据样品种类选择相应的处理方法:
A. 细胞上清:将细胞培养上清液100~500×g离心5min,去除悬浮物后即可;
B. 血清样品:将全血在室温下静置0.5~2h,待其自然凝固并析出血清后,离心取黄色上清即可(4℃,1,000~2,000×g,10min),注意请勿吸取沉淀,制备好的血清需置于冰上待用,请勿在其中添加任何防腐剂或抗凝剂;
C. 血浆样品:使用EDTA对全血进行抗凝处理后,混合均匀置于冰上,离心取黄色上清即可(4℃,1,000~2,000×g,10min),注意请勿吸取沉淀,制备好的血浆需置于冰上待用;
D. 组织均浆/体液:离心去除沉淀即可。
注意:①若待测样品无法及时检测,样品制备完成后,请分装冻存于-20℃,避免反复冻融;
注意:②请保证待测样品清澈透明,检测前如发现样品中有悬浮物,需通过离心去除;
注意:③为了保证检测结果准确,请勿使用溶血、黄疸、高血脂或污染的样品。
2. 样品活化与稀释
样品中的TGF-β1大部分以无活性的复合物形式存在,检测前必须进行活化以释放有活性的TGF-β1蛋白。根据不同样品,按以下步骤进行操作:
A. 血清血浆:① 向920μL样品稀释液中加入20μL样品,混匀;
② 向上步所得的940μL预稀释的样品中添加30μL TGF-β1活化剂Ⅰ,混匀,室温孵育1h;
③ 孵育完成后,再添加30μL TGF-β1活化剂Ⅱ,混匀即完成样品活化。
B. 细胞上清:① 向180μL样品稀释液中加入20μL样品,混匀;
② 向上步所得的200μL预稀释的样品中添加20μL TGF-β1活化剂Ⅰ,混匀,室温孵育1h;
③ 孵育完成后,再添加20μL TGF-β1活化剂Ⅱ,混匀即完成样品活化。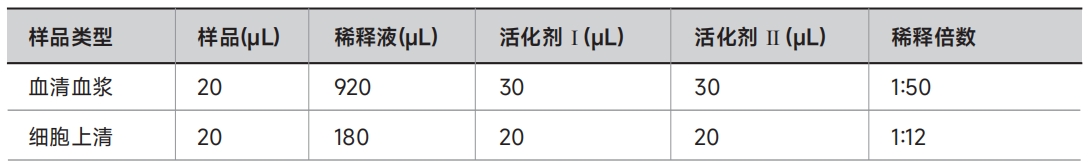
注意: 本试剂盒内的标准品是活化形式的重组TGF-β1,无需再进行活化。
检测准备工作
3. 试剂盒自4℃冰箱取出后,请置于室温平衡20min;如从﹣20℃取出,各组分需彻底融化后再平衡20min;检测完成后,剩余试剂请及时置于4℃或-20℃保存;
4. 将浓缩洗涤液(25×)用双蒸水或去离子水稀释成1×洗涤液;
5. 重组小鼠TGF-β1标准品的稀释和使用(在使用前2h内准备,室温操作,请严格控制在25~28℃)
①配制10ng/mL标准品:取1mL样品稀释液加入标准品管内,盖好后静置15min以上,然后反复颠倒/搓动以助溶解;
②配制1,000pg/mL标准品:取100μL 10ng/mL的标准品加入有900μL样品稀释液的EP管中,混匀,做上标记;
③按下表将1,000pg/mL标准品用样品稀释液进行倍比梯度稀释。(最高浓度为1,000pg/mL,将标准品稀释液作为浓度0pg/mL。)
| 管号 | 稀释液用量(μL) | 复溶后标准品用量(μL) | 标准品的最终浓度(pg/mL) |
| A | 0 | 1,000 | 1,000 |
| B | 300 | 300(从A管中取) | 500 |
| C | 300 | 300(从B管中取) | 250 |
| D | 300 | 300(从C管中取) | 125 |
| E | 300 | 300(从D管中取) | 61.5 |
| F | 300 | 300(从E管中取) | 31.25 |
| G | 300 | 300(从F管中取) | 15.62 |
| H | 300 | 0 | 0 |
6. 准备生物素标记小鼠TGF-β1抗体工作液
①按每孔需添加100μL抗体工作液,计算其总用量(为弥补操作中的损耗,需多配制100~200μL);
②按1μL生物素标记小鼠TGF-β1抗体添加99μL抗体稀释液的比例配制工作液,轻轻混匀。
7. 准备酶复合物工作液(需在使用前1h内准备)
①按每孔需添加100μL酶复合物工作液,计算其总用量(为弥补操作中的损耗,需多配制100~200μL);
②按1μL酶复合物添加99μL酶复合物稀释液的比例配制工作液,轻轻混匀。
检测流程
8. 通过计算确定一次实验所需的板条数,取出所需板条放置于框架内,多余的板条请放回铝箔袋密封,保存于4℃或-20℃;
注意:① 标准品和样品建议做双复孔检测;
注意:② 每次实验均需绘制标准曲线。
9. 将用样品稀释液稀释后的样品和不同浓度标准品(100μL/孔)分别加入相应孔中,用封板胶纸封住反应孔,37℃孵育90min;
注意:① 请查阅相关文献确定样品中待检测蛋白的大致浓度,若其大于本试剂盒标准曲线的最大标准品浓度,请将样品适当稀释后再进行检测;
注意:② 整个加样过程不宜超过10min,否则可能会影响检测结果。
10. 甩去酶标板内液体,无需洗板,将板倒扣在吸水纸上拍干;
11. 加入稀释后的生物素标记小鼠TGF-β1抗体工作液(100μL/孔),用封板胶纸封住反应孔,37℃孵育60min;
12. 洗板5次,每孔1×洗涤液用量为300μL,注入与吸出间隔15~30s,洗完后将板倒扣在吸水纸上拍干;
注意:洗涤过程至关重要,洗涤不充分会导致结果产生较大误差。
13. 加入稀释后的酶复合物(100μL/孔),用封板胶纸封住反应孔,37℃避光孵育30min;
14. 洗板5次,方法同步骤12;
15. 加入显色剂TMB(100μL/孔),用封板胶纸封住反应孔,避光37℃反应10~25min;
注意:① 在保存和使用时,请勿将TMB接触氧化剂和金属;
注意:② 因实验室条件差异,最佳显色时间会有所不同。反应充分时肉眼可见标准品的前3~4孔有明显的梯度蓝色。
16. 加入终止液(100μL/孔),混匀后即刻使用酶标仪测量OD450,同时设定540nm或570nm作为校正波长,即可计算得到校正吸光度值 (OD450-OD540或OD450-OD570);
注意:读取OD值建议在10min内完成。
数据分析
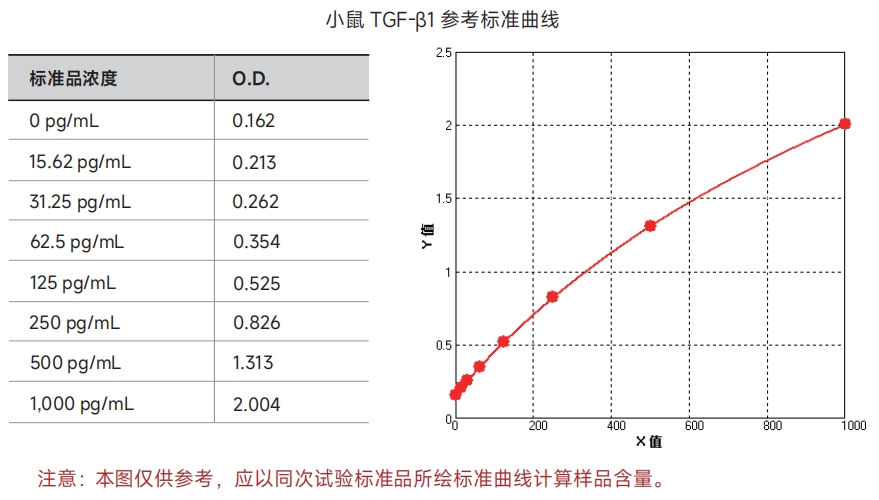
17. 绘制标准曲线。以标准品浓度作横坐标,OD值作纵坐标,利用计算机软件作四参数逻辑(4-PL)曲线拟合创建标准曲线,通过样品的OD值即可在标准曲线上计算出其相应浓度。
注意:① 复孔OD值在20%的差异范围内结果才有效,复孔OD值取平均后可作为测量值;
注意:② 若样品OD值高于标准曲线上限,应适当稀释后重测,计算浓度时应乘以稀释倍数。
标准曲线范例
1. 浓缩洗涤液低温情况下可能会出现结晶,请水浴加热使结晶完全溶解后再配制工作液;
2. 严禁混用不同批号试剂盒的组分;
3. 加样过程请避免产生气泡,实验操作过程中一定要保证试剂充分混匀,否则会使结果产生较大误差;
4. 说明书中提到的室温条件,请严格控制在25~28℃;
5. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
6. 本产品仅限科研使用。