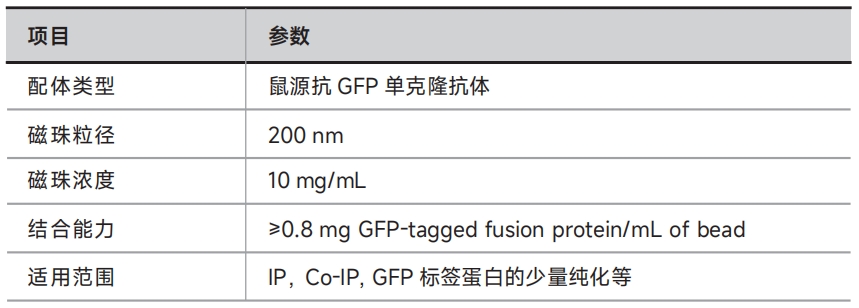
Anti-GFP免疫磁珠采用先进的纳米表面生物技术,将高质量的鼠源单克隆Anti-GFP抗体高密度共价偶联在超顺磁性纳米微球表面,是纯化GFP标签蛋白的理想工具。与市场上同类产品相比,本产品具有更大的特异性表面区域,磁珠使用量更少,非特异性结合率低,使用起来简便高效,可有效避免长时间操作造成目标蛋白被水解,确保了目标蛋白的活性及蛋白复合物的完整性。
本产品可应用于多种样品中抗原的免疫沉淀反应和少量蛋白质的纯化,细胞裂解液、细胞分泌液上清、血清、动物腹水以及其它免疫抗原等均可适用。
样本处理
1. 根据样品种类选择相应的处理方法:
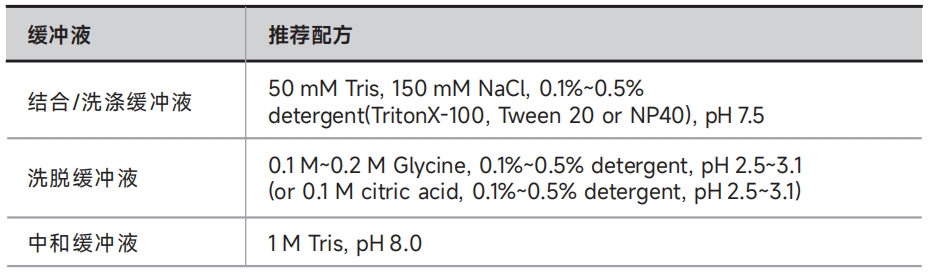
A.悬浮细胞:离心收集细胞(4℃,500×g,10min),弃上清后称重,按每毫克细胞50μL的比例用1×PBS(货号:PS110)洗涤2次;按每毫克细胞5~10μL的比例加入结合/洗涤缓冲液,同时加入蛋白酶抑制剂(货号:GRF101),混匀后置于冰上孵育10min;离心收集上清液(4℃,14,000×g,10min),置于冰上备用(或置于-20℃长期保存);
B.贴壁细胞:移去培养基,按每1.0×105个细胞150μL的比例用1×PBS(货号:PS110)洗涤两次;用细胞刮刀刮落细胞,收集至1.5mL离心管内,按每1.0×105个细胞20~30μL的比例加入结合/洗涤缓冲液,同时加入蛋白酶抑制剂(货号:GRF101),混匀后置于冰上孵育10min;离心收集上清液(4℃,14,000×g,10 min),置于冰上备用(或置于-20℃长期保存);
C. 大肠杆菌:离心收集大肠杆菌(4℃,12,000×g,2min),弃上清后称重,按每克菌体(湿重)10mL的比例用1×PBS(货号:PS110)洗涤2次;按每克菌体(湿重)5~10mL的比例加入结合/洗涤缓冲液 ,同时加入蛋白酶抑制剂(货号:GRF101),重悬菌体,超声裂解细胞,离心收集上清(4℃,12,000×g,10min)。
磁珠预处理
2. 用移液器轻柔吹打Anti-GFP免疫磁珠,使其充分混悬,取25~50μL磁珠悬液置于1.5mL离心管中;
3. 加入500μL结合/洗涤缓冲液,用移液器轻柔吹打重悬磁珠,接着在磁力架上静置1min后, 吸弃上清;
4. 重复步骤3一次;
样品的结合
5. 在预处理后的磁珠中加入500μL步骤1制备好的样品,置于翻转混合仪上孵育(常温1h,4℃ 1~6h或过夜);
6. 将上述混合液置于磁力架上静置1min,然后把上清液转移到新的离心管中备用(上清液可用于检测GFP标签蛋白是否存在残留),原离心管中剩余的即为蛋白-磁珠复合物;
洗涤
7. 向步骤6所得的蛋白-磁珠复合物中加入500μL结合/洗涤缓冲液,用移液器轻柔吹打重悬,接着在磁力架上静置1min后, 吸弃上清;
8. 重复步骤7大约三次,直至洗涤后的上清液OD280小于0.05为止;
注意:如上清液的OD280仍大于0.05,则适当增加洗涤次数。
洗脱
9. 本操作说明书提供以下两种抗原洗脱方案,操作者可根据后期检测的需要选择不同的抗原洗脱方法。
变性洗脱:此方法洗脱的样品适用于SDS-PAGE检测。向步骤8洗涤后的蛋白-磁珠复合物中加入80~100μL 1×SDS-PAGE上样缓冲液(由5×稀释为1×)混合均匀,100℃加热10min。待冷却后,将离心管在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,收集上清,进行SDS-PAGE检测。
非变性洗脱:此方法洗脱的样品保持原有的生物活性,可用于后期功能分析。向步骤8洗涤后的蛋白-磁珠复合物中加入50~100μL洗脱缓冲液,室温孵育5~10min;将离心管在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,收集上清液至新的离心管,每100μL洗出液中加入10μL中和缓冲液将洗脱产物pH调节至中性,用于后期功能分析。
如何避免磁珠在储存或使用过程中可能出现的聚集情况?
答:磁珠应保存在2~8℃,使用时应避免由于污染或干燥而导致的聚集。不过,磁珠在低pH值的缓冲液中发生聚集属于正常现象,不影响磁珠的正常使用。在结合/洗涤缓冲液中添加终浓度为0.1%(V/V)的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可有效防止磁珠聚集。经过低pH值洗脱操作的磁珠可以用结合/洗涤缓冲液洗涤至中性,然后用含有0.1%(V/V)Tween-20的Tris缓冲液(pH7.5)振荡重悬磁珠,并用超声波水浴处理2min,即可使磁珠恢复均匀状态,以上处理均不影响磁珠的抗体结合效率。
如何解决磁珠易粘附管壁的现象?
答:建议使用低吸附率的耗材进行磁珠操作。另外,在缓冲液中添加0.01%~0.1%(V/V)的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可以有效降低耗材对磁珠的粘附。
抗原为何没有免疫沉淀下来?
答:①样品中抗原含量过少,不足以被检测到
建议:通过SDS-PAGE或Western Blot验证裂解液中蛋白的表达和裂解效率;如有必要,可加大样品用量;
②结合/洗涤缓冲液 中的成分干扰了抗原与抗体的结合
建议:使用其它缓冲液进行免疫沉淀和漂洗(比如可选用含有0.5%CHAPS的TBS缓冲液)。
为何获得的蛋白量过低?
答:①蛋白质被降解
建议:加入蛋白酶抑制剂;
②所用的Anti-GFP免疫磁珠量不够
建议:提高Anti-GFP免疫磁珠用量。
为何有多条非特异条带?
答:有非特异性的蛋白结合在磁珠上
建议:在结合/洗涤缓冲液中加入50~350mM NaCl,并加大洗脱力度和次数。
1. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
2. 本产品仅限科研使用。