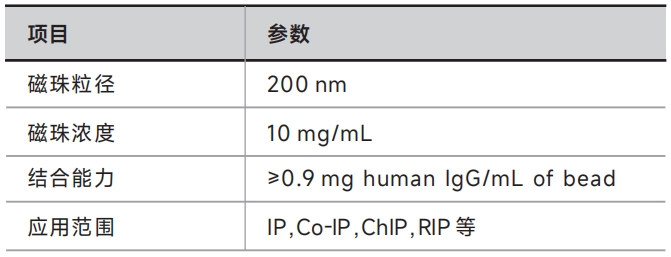
本产品采用新一代纳米表面生物技术,将Protein A高密度共价偶联在超顺磁性纳米微球表面,是纯化大多数免疫球蛋白的理想工具。与传统的Protein A免疫沉淀琼脂糖凝胶相比,Protein A磁珠具有更大的特异性表面区域及更多的表面抗体结合位点,非特异性结合低,并且每次IP和Co-IP可以节省40%的时间,使用起来简便高效。
样本处理
1. 根据样品种类选择相应的处理方法:
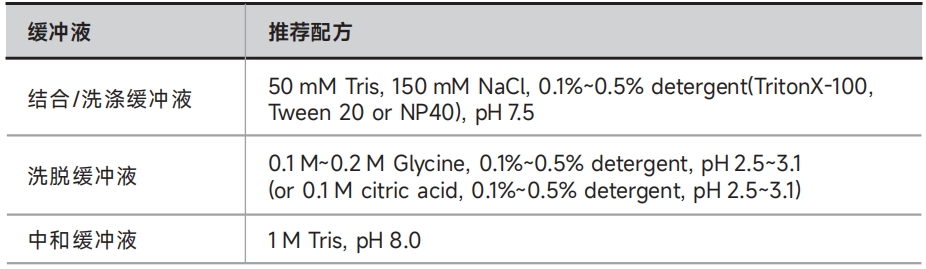
A. 血清样品:若目标蛋白丰度较高,建议用结合缓冲液或1×PBS(货号:PS110)稀释血清样品至目标蛋白终浓度为10~100μg/mL,置于冰上备用(或置于-20℃长期保存);
B. 悬浮细胞:离心收集细胞(4℃,500×g,10min),弃上清后称重,按每毫克细胞50μL的比例用1×PBS(货号:PS110)洗涤2次;按每毫克细胞5~10μL的比例加入结合缓冲液 ,同时加入蛋白酶抑制剂(货号:GRF101),混匀后置于冰上孵育10min;离心收集上清液(4℃,14000×g,10min),置于冰上备用(或置于-20℃长期保存);
C. 贴壁细胞:移去培养基,按每1.0×105个细胞150μL的比例用1×PBS(货号:PS110)洗涤两次;用细胞刮刀刮落细胞,收集至1.5mL离心管内,按每1.0×105个细胞20~30μL的比例加入结合缓冲液,同时加入蛋白酶抑制剂(货号:GRF101),混匀后置于冰上孵育10min;离心收集上清液(4℃,14000×g,10min),置于冰上备用(或置于-20℃长期保存);
D. 大肠杆菌:离心收集大肠杆菌(4℃,12000×g,2min),弃上清后称重,按每克菌体(湿重)10mL的比例用1×PBS(货号:PS110)洗涤2次;按每克菌体(湿重)5~10mL的比例加入结合缓冲液 ,同时加入蛋白酶抑制剂(货号:GRF101),重悬菌体,超声裂解细胞,离心收集上清(4℃,12000×g,10min)。
E. 组织样品:建议使用免疫(共)沉淀裂解液(货号:PS105)进行裂解,具体操作如下:
⑴把组织剪切成细小的碎片;
⑵按照每20mg组织样本150~250μL的比例加入裂解液;
注意:如果样本裂解不充分,可以适当提高裂解液的用量;若需要高浓度的蛋白样品,也可适当降低裂解液的用量。
⑶用玻璃匀浆器匀浆,直至样本充分裂解;
注意:若组织样本非常细小,可以适当剪切后直接加入裂解液,通过强烈涡旋振荡使其裂解充分。
⑷充分裂解后,10,000~14,000×g离心3~5min,小心地将上清液(蛋白样品)移入新的离心管中,即可进行后续步骤。
磁珠预处理
2. 用移液器轻柔吹打Protein A磁珠,使其充分混悬,取25~50μL磁珠悬液置于1.5mL离心管中;
3. 加入500μL结合缓冲液或1×PBS,用移液器轻柔吹打重悬磁珠,接着在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,吸弃上清;
4. 重复步骤3两次;
抗体与磁珠结合
5. 稀释:用结合缓冲液或1×PBS稀释抗体样品至终浓度为5~50μg/mL,置于冰上备用;
6. 结合:将500μL上步稀释好的抗体加入预处理后的磁珠中,置于翻转混合仪上孵育(常温2h,4℃ 4~6h或过夜),接着在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,把上清液转移到新的离心管中备用(上清液可用于检测抗体是否存在残留),离心管中剩余的即为抗体-磁珠复合物
注意:结合过程中,磁珠可能会出现聚团或呈片状,属于正常现象,不会影响实验结果。
7. 洗涤:在上一步得到的抗体-磁珠复合物中加入500μL结合缓冲液或1×PBS,用移液器轻柔吹打重悬磁珠,接着在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,吸弃上清。再重复此步骤两次;
抗原与抗体-磁珠复合物结合
8. 结合:向洗涤后的抗体-磁珠复合物 中加入500μL步骤1制备好的样品,置于翻转混合仪上孵育(常温2h,4℃ 4~6h或过夜),接着在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,吸弃上清,离心管中剩余的即为抗原-抗体-磁珠复合物;
9.洗涤:在上一步得到的抗原-抗体-磁珠复合物中加入1mL洗涤缓冲液或1×PBS,用移液器轻柔吹打重悬磁珠,接着在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,吸弃上清。再重复此步骤三次;
10.洗脱:本操作说明书提供以下两种抗原洗脱方案,操作者可根据后期检测的需要选择不同的抗原洗脱方法。
●变性洗脱:此方法洗脱的样品适用于SDS-PAGE检测。向步骤9洗涤后的抗原-抗体-磁珠复合物中加入60μL 1×SDS-PAGE上样缓冲液(货号:LT101)混合均匀,100℃加热10min。待冷却后,将离心管在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,收集上清,进行SDS-PAGE检测。
●非变性洗脱:此方法洗脱的样品保持原有的生物活性,可用于后期功能分析。向步骤9洗涤后的抗原-抗体-磁珠复合物中加入25~50μL洗脱缓冲液,室温孵育10min;将离心管在磁力架上静置1min,待磁珠吸附到离心管侧壁上后,收集上清液至新的离心管,并立即加入1μL中和缓冲液将洗脱产物pH调节至中性,用于后期功能分析。
如何避免磁珠在储存或使用过程中可能出现的聚集情况?
答: 磁珠应保存在2~8℃,使用时应避免由于污染或干燥而导致的聚集。磁珠在低pH值的洗脱缓冲液中发生聚集属于正常现象,不影响磁珠的正常使用。在结合/洗涤缓冲液和洗脱缓冲液中添加终浓度为0.1%(V/V)的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可有效防止磁珠聚集。经过低pH值洗脱操作的磁珠可以用结合缓冲液洗涤至中性,然后用含有0.1%(V/V)Tween-20的Tris buffer(pH7.5)振荡重悬磁珠,并用超声波水浴处理2min,即可使磁珠恢复均匀状态,以上处理均不影响磁珠的抗体结合效率。
磁珠在使用过程中出现结块现象?
答: 磁珠在极少数情况下会出现结块现象,一般较难振荡打散,从而导致分布不均匀,这主要是因为磁珠在磁场中放置太久而牢固地结合在一起。用超声波水浴处理 2min 即可打散磁珠,但要注意超声处理也会使磁珠在样品溶液中捕获的抗体脱落,因此磁珠在加样后洗脱前不宜使用该方法。
如何提高抗体与磁珠结合效率?
答: 磁珠抗体间的结合效率与抗体的种属来源及所属亚型有关,请确认抗体的类型与Protein A配基的亲和效率。如抗体所属亚型与Protein A的亲和度较低,可以通过增加抗体与磁珠的孵育时间(30~120min)、提高结合缓冲液的pH值(8~9)及降低离子强度(25~10 mM NaCl)等方法提高亲和效率。
如何提高磁珠在免疫沉淀反应中的特异性?
答: 可以先将抗体与样品进行孵育,形成抗体-抗原复合物,再用Protein A磁珠捕获复合物。这种方法可以提高抗体与抗原的结合效率,并降低磁珠与样品接触的时间,从而提高沉淀产物的特异性。对于蛋白质/核酸共沉淀或染色质免疫共沉淀也推荐使用此法。
如何解决磁珠易粘附管壁的现象?
答: 建议使用低吸附率的耗材进行磁珠操作。另外,在缓冲液中添加0.01%~0.1%(V/V)的非离子型去垢剂(如Triton X-100、Tween-20或NP-40)可以有效降低耗材对磁珠的粘附。
1. 为了您的安全和健康,请穿实验服并戴一次性手套操作;
2. 本产品仅限科研使用。
Cheng, Y., Shi, D., Xu, Z., Gao, Z., Si, Z., Zhao, Y., ... & Cheng, D. (2022). 124I-Labeled Monoclonal Antibody and Fragment for the Noninvasive Evaluation of Tumor PD-L1 Expression In Vivo. Molecular Pharmaceutics.(IF 5.364)
Shi, D., Fu, W., Tan, H., Lin, Q., Shi, H., & Cheng, D. (2023). Preclinical Evaluation of 99mTc-MAG3-5-Fab Targeting TREM2 in Lung Cancer Mouse Models: A Comparison with 99mTc-MAG3-5-F (ab′) 2. Molecular Pharmaceutics.(IF 4.9)
Shi, D., Zhang, Y., Xu, Z., Si, Z., Cheng, Y., Cheng, D., & Liu, G. (2022). Noninvasive Evaluation of EGFR Expression of Digestive Tumors Using 99mTc-MAG3-Cet-F (ab) 2-Based SPECT/CT Imaging. Molecular Imaging, 2022.(IF 3.25)